Каково определение щелочного металла?
Щелочные металлы — это шесть химических элементов группы 1, крайнего левого столбца периодической таблицы. Это литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). (Как и другие элементы группы 1, водород (H) имеет один электрон во внешней оболочке, но он не классифицируется как щелочной металл, поскольку при комнатной температуре он является не металлом, а газом.)
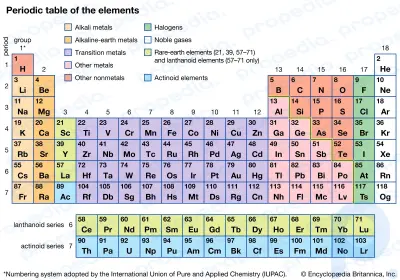
Периодическая таблица элементов. Взгляните на периодическую таблицу элементов.Почему их называют щелочными металлами?
Щелочные металлы названы так потому, что при взаимодействии с водой образуют щелочи. Щелочи представляют собой гидроксидные соединения этих элементов, такие как гидроксид натрия и гидроксид калия. Щелочи – это очень сильные основания, обладающие едким действием. Щелоком, например, является гидроксид натрия. Щелочи реагируют с кислотами с образованием солей.
baseПодробнее о базах.Какими свойствами обладают щелочные металлы?
Щелочные металлы имеют низкие температуры плавления. Литий плавится при 180,5 ° C (356,9 ° F); цезий плавится всего при 28,4 ° C (83,1 ° F). Эти элементы также являются отличными проводниками тепла и электричества. Щелочные металлы очень реакционноспособны и поэтому обычно встречаются в соединениях с другими элементами, такими как соли (хлорид натрия, NaCl) и хлорид калия (KCl).
Подробнее читайте ниже: Общие свойства группы.Какой щелочной металл наиболее распространен?
Самый распространенный щелочной металл — натрий, составляющий 2,8 процента земной коры. Наиболее распространенным соединением натрия является хлорид натрия (NaCl), соль. Следующим по распространенности является калий, который составляет 2,6 процента земной коры. Остальные щелочные металлы встречаются гораздо реже. Рубидий, литий и цезий составляют 0,01, 0,002 и 0,0007 процента земной коры соответственно. Франций радиоактивен, и в природе существуют лишь незначительные его количества.
натрийУзнайте больше о натрии.щелочной металл, любой из шести химических элементов, составляющих группу 1 (Ia) таблицы Менделеева, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (фр.). Щелочные металлы называются так потому, что при реакции с водой образуются щелочи (т. е. сильные основания, способные нейтрализовать кислоты). Натрий и калий являются шестым и седьмым по распространенности элементами, составляя соответственно 2,6 и 2,4 процента земной коры. Другие щелочные металлы встречаются значительно реже: рубидий, литий и цезий составляют соответственно 0,03, 0,007 и 0,0007 процента земной коры. Франций, природный радиоактивный изотоп, очень редок и был обнаружен только в 1939 году.
Щелочные металлы настолько реакционноспособны, что обычно встречаются в природе в сочетании с другими элементами. Простые минералы, такие как галит (хлорид натрия, NaCl), сильвин (хлорид калия, KCl), карналлит (хлорид калия и магния, KCl · MgCl2 · 6H2O), растворимы в воде и поэтому легко извлекаются и очищаются. Однако более сложные, нерастворимые в воде минералы гораздо более распространены в земной коре. Очень разбавленный газ атомарного натрия (около 1000 атомов на кубический см [около 16 000 атомов на кубический дюйм]) образуется в мезосфере Земли (высота около 90 км [60 миль]) в результате абляции метеоров. Последующая реакция натрия с озоном и атомарным кислородом приводит к возбуждению атомов натрия, которые излучают свет, который мы видим как «хвост» метеора, а также более рассеянное ночное свечение атмосферы. Также присутствуют меньшие количества лития и калия.
Щелочные металлы имеют серебристый блеск, высокую пластичность и отличную проводимость электричества и тепла, обычно свойственную металлам. Литий – самый легкий металлический элемент. Щелочные металлы имеют низкие температуры плавления: от 179 ° C (354 ° F) для лития до минимальной 28,5 ° C (83,3 ° F) для цезия. Существуют сплавы щелочных металлов, которые плавятся при температуре -78 ° C (-109 ° F).

Щелочные металлы легко реагируют с кислородом воздуха и водяным паром. (Литий также реагирует с азотом.) Они энергично и часто бурно реагируют с водой с выделением водорода и образованием сильных едких растворов. Наиболее распространенные неметаллические вещества, такие как галогены, галогеновые кислоты, сера и фосфор, реагируют с щелочными металлами. Сами щелочные металлы реагируют со многими органическими соединениями, особенно с теми, которые содержат атом галогена или легкозамещаемый атом водорода.
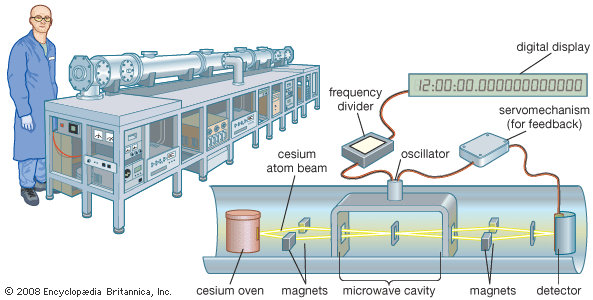
Натрий, безусловно, является наиболее важным щелочным металлом с точки зрения промышленного использования. Металл используется при восстановлении органических соединений и при получении многих коммерческих соединений. Как свободный металл он используется в качестве теплоносителя в некоторых ядерных реакторах. Ежегодно используются сотни тысяч тонн коммерческих соединений, содержащих натрий, в том числе поваренная соль (NaCl), пищевая сода (NaHCO3), карбонат натрия (Na2CO3) и каустическая сода (NaOH). Калий в качестве свободного металла используется значительно меньше, чем натрий. Однако калийные соли расходуются в значительных количествах при производстве удобрений. Металлический литий используется в некоторых сплавах легких металлов и в качестве реагента в органическом синтезе. Важным применением лития является создание легких батарей. Первичные литиевые батареи (неперезаряжаемые) широко используются во многих устройствах, таких как фотоаппараты, сотовые телефоны и кардиостимуляторы. Литиевые аккумуляторные батареи, которые могут быть пригодны для движения транспортных средств или хранения энергии, являются предметом интенсивных исследований. Рубидий, цезий и их соединения имеют ограниченное применение, но пары металлического цезия используются в атомных часах, которые настолько точны, что используются в качестве эталонов времени.
История
Соли щелочных металлов были известны еще древним. В Ветхом Завете упоминается соль под названием нетер (карбонат натрия), которую извлекали из золы растительного сырья. Селитра (нитрат калия) использовалась в порохе, который был изобретен в Китае примерно в 9 веке нашей эры и завезен в Европу в 13 веке.
В октябре 1807 года английский химик сэр Хамфри Дэви выделил калий, а затем натрий. Название «натрий» происходит от итальянского слова «сода» , термина, применявшегося в средние века ко всем щелочам; Калий происходит от французского potasse — названия остатка, остающегося при выпаривании водных растворов, полученных из древесной золы.
Литий был открыт шведским химиком Йоханом Августом Арфведсоном в 1817 году при анализе минерала петалита. Название «литий» происходит от слова «литос» , греческого слова, означающего «камень». Элемент не был выделен в чистом виде до тех пор, пока Дэви не получил небольшое его количество электролизом хлорида лития.
В то время как немецкие химики Роберт Бунзен и Густав Кирхгоф исследовали минеральные воды в Пфальце в 1860 году, они получили фильтрат, который характеризовался двумя линиями в синей области спектра (свет, излучаемый при помещении образца в пламя). . Они предположили наличие нового щелочного элемента и назвали его цезием, происходящим от латинского цезия , используемого для обозначения синевы неба. Те же исследователи, извлекая щелочи из минерала лепидолита, выделили еще один раствор, который дал две спектральные линии красного цвета. Они предложили название рубидий для элемента в этом растворе от латинского рубидуса , который использовался для обозначения самого темного красного цвета. Франций не был открыт до 1939 года Маргаритой Перей из Радиевого института в Париже.
В XIX веке единственным применением щелочных металлов было использование натрия в качестве реагента при производстве алюминия. Когда был разработан электролитический процесс очистки алюминия, казалось, что крупномасштабное использование натрия прекратится. Однако последующие усовершенствования в электролитическом производстве натрия снизили стоимость этого элемента до такой степени, что его можно экономически использовать для производства присадок к бензинам, реагентов для химической промышленности, гербицидов, инсектицидов, нейлона, фармацевтических препаратов и реагентов для рафинирования металлов. . Непрерывный электролиз гидроксида натрия, метод, называемый процессом Кастнера, был заменен в 1926 году процессом с ячейкой Даунса. Этот процесс, в котором расплавленная смесь хлорида натрия и хлорида кальция (для снижения температуры плавления) подвергается электролизу, приводит к образованию как металлического натрия, так и хлора.