ion carbonio, cualquier miembro de una clase de moléculas orgánicas con cargas positivas localizadas en un átomo de carbono. Ciertos iones de carbonio se pueden preparar de tal manera que sean lo suficientemente estables para su estudio; más frecuentemente son sólo formas de vida corta (intermedias) que ocurren durante reacciones químicas.
De hecho, los iones de carbonio son una de las clases más comunes de intermediarios en reacciones orgánicas, y el conocimiento de las estructuras y propiedades de estas sustancias es fundamental para comprender las reacciones en las que ocurren. Muchas de estas reacciones son de importancia sintética, bioquímica o industrial.
Los primeros iones de carbonio se observaron en 1901; Sin embargo, no fue hasta 21 años después que el químico alemán Hans Meerwein concluyó que se formaba un producto neutro (cloruro de isobornilo) a partir de un reactivo neutro (clorhidrato de canfeno) mediante una transposición que involucraba un ion carbonio intermedio. Esta fue la primera conceptualización de un ion carbonio como intermedio en una reacción de reordenamiento orgánico. La idea fue generalizada por el químico estadounidense Frank Clifford Whitmore a partir de 1932 y colocada sobre una base experimental firme por los químicos ingleses Sir Christopher Ingold y ED Hughes, a partir de finales de la década de 1920. Aunque se habían hecho muchas conjeturas sobre los iones carbonio mediante métodos indirectos, no fue hasta después de 1960 que se dispuso de métodos generales para la formación de iones carbonio estables y de larga vida.
Clasificación.
Se han llegado a reconocer dos clases distintas de iones de carbonio. Los primeros son los iones carbonio “clásicos”, que contienen un átomo de carbono trivalente en el centro. El átomo de carbono se encuentra en un estado de hibridación sp 2, es decir, tres electrones del átomo de carbono ocupan orbitales formados por la combinación (hibridación) de tres orbitales ordinarios, uno denominado s y dos, p. Los tres orbitales se encuentran en un plano; por tanto, el centro catiónico de la molécula formada al unir el átomo de carbono con otros tres átomos o grupos tiende a ser plano. El padre de estos iones es el catión metilo, con la fórmula CH+3. Esquemáticamente, la estructura es como se muestra a continuación (las líneas continuas representan enlaces entre átomos):

La segunda clase de iones carbonio incluye los iones carbonio pentacoordinados o “no clásicos”, que tienen tres enlaces sencillos, cada uno de los cuales une el átomo de carbono con otro átomo, y un enlace de dos electrones que conecta tres átomos, en lugar de los dos habituales. , con un solo par de electrones. La estructura original de estos iones es la del ion metonio, CH+5, en el que las líneas de puntos representan un enlace de tres centros:
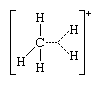
Con frecuencia es posible distinguir experimentalmente entre estos dos tipos de iones carbonio, como por ejemplo mediante el uso de ciertos métodos instrumentales. Estos métodos incluyen la espectroscopia de resonancia magnética nuclear, que proporciona información sobre los núcleos atómicos; espectroscopia infrarroja y Raman, que se basan en la absorción de luz; y, más recientemente, la espectroscopia de emisión de electrones inducida por rayos X, que proporciona información sobre las energías de los enlaces.
Preparación y estabilidad.
Se conocen varios métodos para la generación de iones carbonio. Sin embargo, todos pueden clasificarse en una de las siguientes categorías: (1) escisión heterolítica (asimétrica) del enlace de dos electrones entre un átomo de carbono y un grupo unido; (2) eliminación de electrones de un compuesto orgánico neutro; (3) adición de un protón u otro catión a un sistema insaturado; y (4) protonación o alquilación (adición de un grupo alquilo o hidrocarburo) de un enlace simple carbono-carbono o carbono-hidrógeno. Dado que los iones de carbonio son especies cargadas positivamente, se forman más fácilmente en disolventes relativamente polares (disolventes que consisten en moléculas con distribución asimétrica de electrones), que ayudan a dispersar sus cargas o las cargas de los iones negativos que las acompañan en todo el medio. Los disolventes comúnmente utilizados incluyen metanol, acetona acuosa, ácido acético y ácido trifluoroacético.
El destino de un ion carbonio producido por uno de estos métodos está determinado esencialmente por dos factores: (1) la naturaleza del medio en el que se genera el ion y (2) la estabilidad inherente del ion mismo. Los iones de carbonio reaccionan rápidamente con el disolvente o con cualquier sustancia disponible atraída por entidades cargadas positivamente. Por lo tanto, los iones de carbonio tienen sólo una existencia fugaz y para su estudio deben utilizarse métodos indirectos. Los métodos comunes son la cinética (mediciones de velocidades de reacción), el análisis químico del producto formado por la reacción del ion carbonio (en particular, la determinación de la disposición espacial de los átomos en una molécula) y el marcaje isotópico (es decir, el uso de sustancias radiactivas). isótopos para identificar átomos particulares).
Se han encontrado disolventes que no reaccionan con muchos carbocationes. Estos disolventes son fluoruro de hidrógeno-pentafluoruro de antimonio y ácido fluorosulfúrico-pentafluoruro de antimonio con dióxido de azufre o fluoruro de cloruro de sulfurilo también presentes. En estos disolventes, la vida útil de muchos iones carbonio es suficiente para permitir la observación directa.
Los iones de carbonio terciario son generalmente más estables que los iones de carbonio secundarios, los cuales, a su vez, son más estables que los primarios. En los iones carbonio terciario, el carbono sp 2 está unido a tres grupos alquilo; en los iones carbonio secundarios, el átomo de carbono sp 2 está unido a dos grupos alquilo y un átomo de hidrógeno; en los iones carbonio primarios, el carbono sp 2 está unido a un grupo alquilo y dos átomos de hidrógeno o, en el caso del catión metilo, a tres átomos de hidrógeno. A continuación se muestran ejemplos de cada uno.

Este orden de estabilidad relativa se explica sobre la base de la capacidad de un grupo alquilo para dispersar la carga en el átomo de carbono sp 2.
Los cationes bencilo son más estables que la mayoría de los cationes primarios porque en los iones bencilo la carga positiva puede distribuirse entre los átomos de carbono del anillo aromático, de modo que el catión puede existir en muchas formas, todas las cuales contribuyen a la estructura general. Estas formas del catión bencilo se muestran a continuación:
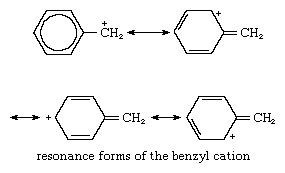
En estas estructuras, el anillo de benceno está indicado por un hexágono, cada esquina del cual se considera un átomo de carbono (no se muestran los hidrógenos unidos). La forma con un círculo en el hexágono representa estructuras con enlaces simples y dobles alternos en el anillo; las otras formas son aquellas en las que aparecen cargas en varios lugares del ring.
Reacciones.
Dado que los iones de carbonio son entidades deficientes en electrones, reaccionan con cualquier molécula donadora de electrones, que también se denomina nucleófilos. Hay tres tipos de nucleófilos: n -bases, bases pi y bases sigma, en las que n, pi y sigma se refieren al estado de enlace del par donante-electrón en el nucleófilo, es decir, no enlazado, con enlace pi, y enlazados en sigma, respectivamente. (Los enlaces sigma son enlaces covalentes ordinarios entre átomos, y los enlaces pi son enlaces especiales que se producen en sistemas aromáticos e insaturados). El nucleófilo puede ser externo o interno (es decir, constituir una porción del catión mismo). En este último caso, puede ocurrir una reordenación. A continuación se muestran ejemplos de los distintos tipos de reacciones posibles:
1. Reacción con n -base externa: hidratación catalizada por ácido (adición de agua) de isobutileno. En esta reacción, hay un par de electrones no compartidos (no enlazados) en el átomo de oxígeno de la molécula de agua:

2. Reacción con base externa: alquilación de benceno utilizando cloruro de isopropilo (reacción de Friedel-Crafts). El benceno actúa como molécula donante, y los electrones donados provienen del sistema de enlace pi del anillo de benceno:

En la ecuación anterior, el círculo parcial con la carga positiva en el hexágono representa aquellas formas del catión en las que la carga positiva se distribuye alrededor del anillo (como en el catión bencilo, en la imagen de arriba).
3. Reacción con base sigma externa: reacción de transferencia de hidruro en la que el par de electrones donador proviene del enlace sigma carbono-hidrógeno en isobutano:
4. Reacción con n -base interna: reacción de ciclación, con un par de electrones no enlazados en un átomo de oxígeno que actúa como donante:
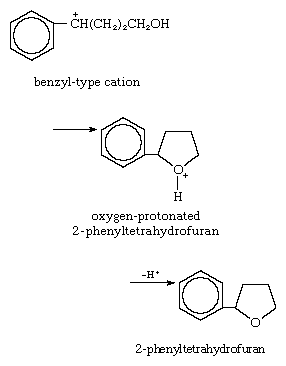
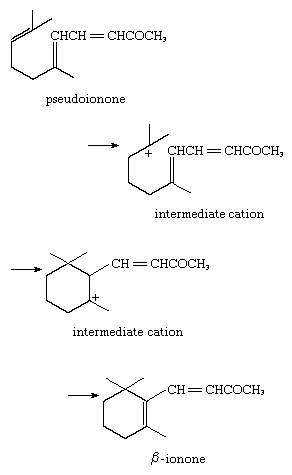
5. Reacción con base pi interna: ciclación catalizada por ácido para formar β -ionona, con los electrones donantes provenientes de los electrones pi del sistema insaturado:
6. Reacción con base sigma interna: reordenamiento catalizado por ácido del alcohol neopentílico, el par de electrones proveniente de un enlace sigma interno carbono-carbono:
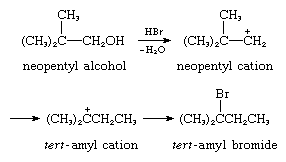
Cada uno de estos tipos de reacción se emplea ampliamente en reacciones orgánicas sintéticas, y las numerosas reacciones de transformación de hidrocarburos catalizadas por ácido son fundamentales en la química del petróleo y en procesos bioorgánicos vitales. Un proceso importante en la fabricación de gasolina de alto octanaje, por ejemplo, consiste en la isomerización catalizada por ácido de hidrocarburos de cadena lineal a hidrocarburos de cadena ramificada. Un ejemplo de la importancia de los iones carbonio en los procesos bioorgánicos se puede encontrar en la síntesis biológica del importante material colesterol a partir de un precursor, el escualeno, mediante otro compuesto, el lanosterol. En esta transformación, los reordenamientos catalizados por ácido (reacción tipo 6, descrita anteriormente) ocurren repetidamente.
George A. OlahPaul R. CliffordLos editores de la Encyclopaedia ProPedia